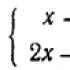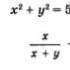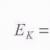Составление уравнений окислительно-восстановительных реакций методом электронного баланса. Химия Как делается электронный баланс в химии
Данный метод основан на представлении о степени окисления атома в веществе. Степень окисления - это условный заряд атома, найденный исходя из предположения, что все связи в веществе чисто ионные. Степень окисления обозначается арабской цифрой со знаком (+) или (-).
1. Написать схему реакции. Схема реакции - это условное химическое выражение, в котором слева указаны исходные вещества, справа - известные продукты реакции. Между правой и левой частями схемы ставится знак “стрелка”. Схема может быть полной (известны все продукты) и неполной (известна только часть продуктов). Метод электронного баланса позволяет работать только с полными схемами. Единственным веществом, которое можно не указывать в схеме является вода.
Пример: Cu + HNO 3 ® Cu(NO 3) 2 + NO + . . . .
(многоточие означает, что в правой и левой части окончательного уравнения может появиться вода).
2. Над каждым атомом в схеме поставить степени окисления:
3. Найти атомы, изменившие свои степени окисления. Составить для них уравнения электронных переходов:
Cu 0 + H +1 N +5 O ® Cu +2 (N +5 O ) 2 + N +2 O -2 + . . . .
Cu 0 - 2 = Cu +2 ,
N +5 + 3 = N +2 .
4. Сделать электронный баланс (подобрать коэффициенты, на которые нужно умножить уравнения электронных переходов, чтобы число электронов, ушедших от восстановителей, было равно количеству электронов, принятых окислителем).
Cu 0 - 2 = Cu +2 3
N +5 + 3 = N +2 2
Из электронного баланса следует, что в левой части полученного уравнения на каждые 3 атома восстановителя (Cu +2) должно приходиться 2 атома окислителя (N +5). В правой части будущего уравнения на 3 атома Cu +2 должно приходиться 2 атома N +2 .
5. В схеме реакции поставить первые коэффициенты в соответствии с электронным балансом (там, где это возможно!).
3Cu + HNO 3 ® 3Cu(NO 3) 2 + 2NO + . . . .
Обратите внимание: из четырех теоретически возможных коэффициентов указаны только три. Перед азотной кислотой коэффициент пока неизвестен, т.к. N +5 ведет себя сложным образом: с одной стороны принимает участие в ОВР (это учтено в электронном балансе), а с другой - переходит без изменений в нитрат меди (Сu(NO 3) 2) (это не учтено в электронном балансе, т.к. при этом степень окисления азота не меняется).
6. Уравнять по всем атомам, кроме водорода и кислорода. При этом произвольное изменение коэффициентов, полученных из электронного баланса недопустимо.
3Cu + 8 HNO 3 ® 3Cu(NO 3) 2 + 2NO + . . . .
7. Уравнять по водороду. Это делается только одним способом: добавлением соответствующего числа молекул воды в ту часть схемы, где водорода не хватает. В данном примере слева 8 атомов водорода, а справа - нуль. Молекула Н 2 О содержит 2 атома водорода:
3Cu + 8HNO 3 ® 3Cu(NO 3) 2 + 2NO + 4H 2 O.
8. Полученное выражение должно быть уравнением ОВР, если до того не было допущено ошибки. Необходимо проверить данное уравнение по кислороду. Если справа и слева количество атомов кислорода одинаково, вместо “стрелки” ставим знак “равно” (это уравнение). Если по кислороду не сошлось, то следует повторить уравнивание, начиная с пункта 1.
Окончательное уравнение:
3Cu + 8HNO 3 = 3Cu(NO 3) 2 + 2NO + 4H 2 O.
Задачник по общей и неорганической химии
2.2. Окислительно-восстановительные реакции
Смотрите задания >>>Теоретическая часть
К окислительно-восстановительным реакциям относятся химические реакции, которые сопровождаются изменением степеней окисления элементов. В уравнениях таких реакций подбор коэффициентов проводят составлением электронного баланса . Метод подбора коэффициентов с помощью электронного баланса складывается из следующих этапов:
а) записывают формулы реагентов и продуктов, а затем находят элементы, которые повышают и понижают свои степени окисления, и выписывают их отдельно:
MnCO 3 + KClO 3 ® MnO 2 + KCl + CO 2
Cl V ¼ = Cl - I
Mn II ¼ = Mn IV
б) составляют уравнения полуреакций восстановления и окисления, соблюдая законы сохранения числа атомов и заряда в каждой полуреакции :
полуреакция восстановления Cl V + 6 e - = Cl - I
полуреакция окисления Mn II - 2 e - = Mn IV
в) подбирают дополнительные множители для уравнения полуреакций так, чтобы закон сохранения заряда выполнялся для реакции в целом, для чего число принятых электронов в полуреакциях восстановления делают равным числу отданных электронов в полуреакции окисления:
Cl V + 6 e - = Cl - I 1
Mn II - 2 e - = Mn IV 3
г) проставляют (по найденным множителям) стехиометрические коэффициенты в схему реакции (коэффициент 1 опускается):
3 MnCO 3 + KClO 3 = 3 MnO 2 + KCl + CO 2
д ) уравнивают числа атомов тех элементов, которые не изменяют своей степени окисления при протекании реакции (если таких элементов два, то достаточно уравнять число атомов одного из них, а по второму провести проверку). Получают уравнение химической реакции:
3 MnCO 3 + KClO 3 = 3 MnO 2 + KCl + 3 CO 2
Пример 3 . Подберите коэффициенты в уравнении окислительно-восстановительной реакции
Fe 2 O 3 + CO ® Fe + CO 2
Решение
Fe 2 O 3 + 3 CO = 2 Fe +3 CO 2
Fe III + 3 e - = Fe 0 2
C II - 2 e - = C IV 3
При одновременном окислении (или восстановлении) атомов двух элементов одного вещества расчет ведут на одну формульную единицу этого вещества.
Пример 4. Подберите коэффициенты в уравнении окислительно-восстановительной реакции
Fe(S) 2 + O 2 = Fe 2 O 3 + SO 2
Решение
4 Fe(S) 2 + 11 O 2 = 2 Fe 2 O 3 + 8 SO 2
Fe II - e - = Fe III
- 11 e - 4
2S - I - 10 e - = 2S IV
O 2 0 + 4 e - = 2O - II + 4 e - 11
В примерах 3 и 4 функции окислителя и восстановителя разделены между разными веществами, Fe 2 O 3 и O 2 - окислители, СО и Fe (S ) 2 - восстановители ; такие реакции относят к межмолекулярным окислительно-восстановительным реакциям.
В случае внутримолекулярного окисления-восстановления, когда в одном и том же веществе атомы одного элемента окисляются, а атомы другого элемента восстанавливаются, расчет ведут на одну формульную единицу вещества.
Пример 5. Подберите коэффициенты в уравнении реакции окисления-восстановления
(NH 4) 2 CrO 4 ® Cr 2 O 3 + N 2 +H 2 O + NH 3
Решение
2 (NH 4) 2 CrO 4 = Cr 2 O 3 + N 2 +5 H 2 O + 2 NH 3
Cr VI + 3 e - = Cr III 2
2N - III - 6 e - = N 2 0 1
Для реакций дисмутации (диспропорционирования , самоокисления - самовосстановления), в которых атомы одного и того же элемента в реагенте окисляются и восстанавливаются, дополнительные множители проставляют вначале в правую часть уравнения, а затем находят коэффициент для реагента.
Пример 6 . Подберите коэффициенты в уравнении реакции дисмутации
H 2 O 2 ® H 2 O + O 2
Решение
2 H 2 O 2 = 2 H 2 O + O 2
O - I + e - = O - II 2
2O - I - 2 e - = O 2 0 1
Для реакции конмутации (синпропорционирования ), в которых атомы одного и того же элемента разных реагентов в результате их окисления и восстановления получают одинаковую степень окисления, дополнительные множители проставляют вначале в левую часть уравнения.
Пример 7. Подберите коэффициенты в уравнении реакции конмутации :
H 2 S + SO 2 = S + H 2 O
Решение
2 H 2 S + SO 2 = 3 S + 2H 2 O
S - II - 2 e - = S 0 2
S IV + 4 e - = S 0 1
Для подбора коэффициентов в уравнениях окислительно-восстановительных реакций, протекающих в водном растворе при участии ио нов, используют метод электронно-ионного баланса. Метод подбора коэффициентов с помощью электронно-ионного баланса складывается из следующих этапов:
а) записывают формулы реагентов данной окислительно-восстановительной реакции
K 2 Cr 2 O 7 + H 2 SO 4 + H 2 S
и устанавливают химическую функцию каждого из них (здесь K 2 Cr 2 O 7 - окислитель, H 2 SO 4 - кислотная среда реакции, H 2 S - восстановитель);
б) записывают (на следующей строчке) формулы реагентов в ионном виде, указывая только те ионы (для сильных электролитов), молекулы (для слабых электролитов и газов) и формульные единицы (для твердых веществ), которые примут участие в реакции в качестве окислителя (Cr 2 O 7 2 - ), среды (Н + - точнее, катиона оксония H 3 O + ) и восстановителя (H 2 S ):
Cr 2 O 7 2 - + H + + H 2 S
в) определяют восстановленную формулу окислителя и окисленную форму восстановителя, что должно быть известно или задано (так, здесь дихромат-ион переходит катионы хрома(III ), а сероводород - в серу); эти данные записывают на следующих двух строчках, составляют электронно-ионные уравнения полуреакций восстановления и окисления и подбирают дополнительные множители для уравнений полуреакций :
полуреакция восстановления Cr 2 O 7 2 - + 14 H + + 6 e - = 2 Cr 3+ + 7 H 2 O 1
полуреакция окисления H 2 S - 2 e - = S (т) + 2 H + 3
г) составляют, суммируя уравнения полуреакций , ионное уравнение данной реакции, т.е. дополняют запись (б):
Cr 2 O 7 2 - + 8 H + + 3 H 2 S = 2 Cr 3+ + 7 H 2 O + 3 S ( т )
д ) на основе ионного уравнения составляют молекулярное уравнение данной реакции, т.е. дополняют запись (а), причем формулы катионов и анионов, отсутствующие в ионном уравнении, группируют в формулы дополнительных продуктов (K 2 SO 4 ):
K 2 Cr 2 O 7 + 4H 2 SO 4 + 3H 2 S = Cr 2 (SO 4) 3 + 7H 2 O + 3S ( т ) + K 2 SO 4
е) проводят проверку подобранных коэффициентов по числу атомов элементов в левой и правой частях уравнения (обычно достаточно только проверить число атомов кислорода).
Окисленная и восстановленная формы окислителя и восстановителя часто отличаются по содержанию кислорода (сравните Cr 2 O 7 2 - и Cr 3+ ). Поэтому при составлении уравнений полуреакций методом электронно-ионного баланса в них включают пары Н + / Н 2 О (для кислотной среды) и ОН - / Н 2 О (для щелочной среды). Если при переходе от одной формы к другой исходная форма (обычно - окисленная) теряет свои оксид-ионы (ниже показаны в квадратных скобках), то последние, так как они не существуют в свободном виде, должны быть в кислотной среде соединены с катионами водорода, а в щелочной среде - с молекулами воды, что приводит к образованию молекул воды (в кислотной среде) и гидроксид-ионов (в щелочной среде ):
кислотная среда[ O 2 - ] + 2 H + = H 2 O
щелочная среда[ O 2 - ] + H 2 О = 2 ОН -
Недостаток оксид-ионов в исходной форме (чаще - в восстановленной) по сравнению с конечной формой компенсируется добавлением молекул воды (в кислотной среде) или гидроксид-ионов (в щелочной среде):
кислотная среда H 2 O = [ O 2 - ] + 2 H +
щелочная среда2 ОН - = [ O 2 - ] + H 2 О
Пример 8. Подберите коэффициенты методом электронно-ионного баланса в уравнении окислительно-восстановительной реакции:
® MnSO 4 + H 2 O + Na 2 SO 4 + ¼
Решение
2 KMnO 4 + 3 H 2 SO 4 + 5 Na 2 SO 3 =
2 MnSO 4 + 3 H 2 O + 5 Na 2 SO 4 + + K 2 SO 4
2 MnO 4 - + 6 H + + 5 SO 3 2 - = 2 Mn 2+ + 3 H 2 O + 5 SO 4 2 -
MnO 4 - + 8 H + + 5 e - = Mn 2+ + 4 H 2 O2
SO 3 2 - + H 2 O - 2 e - = SO 4 2 - + 2 H + 5
Пример 9 . Подберите коэффициенты методом электронно-ионного баланса в уравнении окислительно-восстановительной реакции:
Na 2 SO 3 + KOH + KMnO 4 ® Na 2 SO 4 + H 2 O + K 2 MnO 4
Решение
Na 2 SO 3 + 2 KOH + 2 KMnO 4 = Na 2 SO 4 + H 2 O + 2 K 2 MnO 4
SO 3 2 - + 2 OH - + 2 MnO 4 - = SO 4 2 - + H 2 O + 2 MnO 4 2 -
MnO 4 - + 1 e - = MnO 4 2 - 2
SO 3 2 - + 2 OH - - 2 e - = SO 4 2 - + H 2 О 1
Если перманганат-ион используется в качестве окислителя в слабокислотной среде, то уравнение полуреакции восстановления:
MnO 4 - + 4 H + + 3 e - = Mn О 2( т ) + 2 H 2 O
а если в слабощелочной среде, то
MnO 4 - + 2 H 2 О + 3 e - = Mn О 2( т) + 4 ОН -
Часто слабокислую и слабощелочную среду условно называют нейтральной, при этом в уравнения полуреакций слева вводят только молекулы воды. В этом случае при составлении уравнения следует (после подбора дополнительных множителей) записать дополнительное уравнение, отражающее образование воды из ионов Н + и ОН - .
Пример 10 . Подберите коэффициенты в уравнении реакции, протекающей в нейтральной среде:
KMnO 4 + H 2 О + Na 2 SO 3 ® Mn О 2( т ) + Na 2 SO 4 ¼
Решение
2 KMnO 4 + H 2 О + 3 Na 2 SO 3 = 2 Mn О 2( т ) + 3 Na 2 SO 4 + 2 КОН
MnO 4 - + H 2 О + 3 SO 3 2 - = 2 Mn О 2( т ) + 3 SO 4 2 - + 2 ОН -
MnO 4 - + 2 H 2 О + 3 e - = Mn О 2( т) + 4 ОН -
SO 3 2 - + H 2 O - 2 e - = SO 4 2 - + 2 H +
8ОН - + 6 Н + = 6 Н 2 О + 2 ОН -
Таким образом, если реакцию из примера 10 проводят простым сливанием водных растворов перманганата калия и сульфита натрия, то она протекает в условно нейтральной (а в действительности, в слабощелочной) среде из-за образования гидроксида калия. Если же раствор перманганата калия немного подкислить, то реакция будет протекать в слабокислотной (условно нейтральной) среде.
Пример 11 . Подберите коэффициенты в уравнении реакции, протекающей в слабокислотной среде:
KMnO 4 + H 2 SO 4 + Na 2 SO 3 ® Mn О 2( т ) + H 2 O + Na 2 SO 4 + ¼
Решение
2KMnO 4 + H 2 SO 4 + 3Na 2 SO 3 = 2MnО 2( т ) + H 2 O + 3Na 2 SO 4 + K 2 SO 4
2 MnO 4 - + 2 H + + 3 SO 3 2 - = 2 Mn О 2( т ) + Н 2 О + 3 SO 4 2 -
MnO 4 - + 4 H + + 3 e - = Mn О 2( т ) + 2 H 2 O2
SO 3 2 - + H 2 O - 2 e - = SO 4 2 - + 2 H + 3
Формы существования окислителей и восстановителей до и после реакции, т.е. их окисленные и восстановленные формы, называют окислительно-восстановительными парами . Так, из химической практики известно (и это требуется запомнить), что перманганат-ион в кислотной среде образует катион марганца(II ) (пара MnO 4 - + H + / Mn 2+ + H 2 O ), в слабощелочной среде - оксид марганца(IV ) (пара MnO 4 - + H + ¤ Mn О 2(т) + H 2 O или MnO 4 - + H 2 О = Mn О 2(т) + ОН - ). Состав окисленных и восстановленных форм определяется, следовательно, химическими свойствами данного элемента в различных степенях окисления, т.е. неодинаковой устойчивостью конкретных форм в различных средах водного раствора. Все использованные в настоящем разделе окислительно-восстановительные пары приведены в задачах 2.15 и 2.16.
|
Восстановители |
Окислители |
|
металлы, водород, уголь |
галогены |
|
оксид углерода (II) CO |
оксид марганца (VII) - Mn 2 O 7 |
|
сероводород H 2 S |
оксид марганца (IV) - MnO 2 |
|
сульфид натрия Na 2 S |
перманганат калия - KMnO 4 |
|
оксид серы (IV) - SO 2 |
манганат калия - K 2 MnO 4 |
|
сернистая кислота - H 2 SO 3 и ее соли |
оксид хрома (VI) - CrO 3 |
|
тиосульфат натрия - Na 2 S 2 O 3 |
хромат калия - K 2 CrO 4 |
|
иодоводородная кислота - HI |
дихромат калия - K 2 Cr 2 O 7 |
|
бромоводородная кислота - HBr соляная кислота – HCl хлорид олова (II) - SnCl 2 сульфат железа (II) - FeSO 4 сульфат марганца (II) - MnSO 4 сульфат хрома (III) - Cr 2 (SO 4) 3 азотистая кислота - HNO 2 аммиак NH 3 гидразин N 2 H 4 оксид азота (II) NO фосфористая кислота - H 3 PO 3 ортомышьяковистая кислота - H 3 AsO 3 гексацианоферрат (II) калия - K 4 |
азотная кислота - HNO 3 кислород - О 2 озон - О 3 пероксид водорода - Н 2 О 2 серная кислота - H 2 SO 4 (конц.) селеновая кислота - H 2 SeO 4 оксид меди (II) - CuO оксид серебра (I) - Ag 2 O оксид свинца (IV) - PbO 2 ионы благородных металлов (Ag+, Au 3+ и др.) висмутат натрия - NaBiO 3 персульфат аммония - (NH 4) 2 S 2 O 8 гексацианоферрат (III) калия –K 3 хлорид железа (III) – FeCl 3 гипохлориты, хлораты, перхлораты царская водка смесь концентрированных азотной и плавиковой кислот |
9.3. Влияние среды на окислительно-восстановительные реакции
Характер среды (кислотный, нейтральный, щелочной) влияет на ОВР. В разных средах при взаимодействии одних и тех же веществ могут получаться различные продукты. В этом мы убедились на примерах, рассмотренных в разделе 9.1, где окислителем является перманганат – ион MnO:
окисленная форма восстановленная форма
кислая среда Mn 2+ б/ц или слабо-розовая
рн 7 окраска р-ра
7 нейтральная среда +4
MnO рн 7 MnO 2 (бурый осадок)
щелочная среда (MnO 4) 2- (зелёная окраска
рн 7 раствора)
Перманганат–ион окислительные свойства в большей степени проявляет в кислой среде (большее понижение степени окисления).
Обычно для создания в растворе кислой среды используют серную кислоту. Азотную и соляную (хлороводородную) кислоты применяют редко: первая сама является окислителем, вторая способна окисляться. Для создания щелочной среды применяют растворы гидроксида калия или натрия.
Рассмотрим примеры влияния среды на течение реакции с участием пероксида водорода. Пероксид водорода в зависимости от среды восстанавливается согласно схеме:
кислая среда pн 7
H 2 O 2 + 2H + + 2e - = H 2 O
нейтральная среда
щелочная среда H 2 O 2 + 2e - = 2OH -
Здесь H 2 O 2 выступает как окислитель. Например:
2FeSO 4 + H 2 O 2 + H 2 SO 4 = Fe 2 (SO 4) 3 + 2 H 2 O
2 Fe 2+ - e - = Fe 3+
1 H 2 O 2 + 2H + + 2e = 2 H 2 O
2Fe 2+ + H 2 O 2 + 2H + = 2Fe 3+ + 2 H 2 O
Однако, с очень сильным окислителем, таким, как KMnO 4 , пероксид водорода взаимодействует как восстановитель:
H 2 O 2 - 2e - = O 2 + 2H +
Например:
5 H 2 O 2 + 2 KMnO 4 + 3H 2 SO 4 = 5 O 2 + 2 MnSO 4 + K 2 SO 4 + 8H 2 O
5 H 2 O 2 - 2e - = O 2 + 2H +
2 MnO - 4 + 8H + + 5e = Mn 2+ + 4H 2 O
5 H 2 O 2 + 2 MnO - 4 + 6H + = 5 O 2 + 2 Mn 2+ + 8H 2 O
Хром в своих соединениях имеет устойчивые с.о. (+6) и (+3). В первом случае соединения хрома (хромат-, дихромат-ионы) проявляют свойства окислителей, во втором – восстановителей. Хромат и дихромат-ионы – сильные окислители, восстанавливаются до соединений Cr 3+ :
окисленная форма восстановленная форма
Спецификой многих ОВР является то, что при составлении их уравнений подбор коэффициентов вызывает затруднение. Для облегчения подбора коэффициентов чаще всего используют метод электронного баланса и ионно-электронный метод (метод полуреакций). Рассмотрим применение каждого из этих методов на примерах.
Метод электронного баланса
В его основе лежит следующее правило : общее число электронов, отдаваемое атомами-восстановителями, должно совпадать с общим числом электронов, которые принимают атомы-окислители .
В качестве примера составления ОВР рассмотрим процесс взаимодействия сульфита натрия с перманганатом калия в кислой среде.
- Сначала необходимо составить схему реакции: записать вещества в начале и конце реакции, учитывая, что в кислой среде MnO 4 — восстанавливается до Mn 2+ ():
- Далее определим какие из соединений являются ; найдем их степень окисления в начале и конце реакции:
Na 2 S +4 O 3 + KMn +7 O 4 + H 2 SO 4 = Na 2 S +6 O 4 + Mn +2 SO 4 + K 2 SO 4 + H 2 O
Из приведенной схемы понятно, что в процессе реакции происходит увеличение степени окисления серы с +4 до +6, таким образом, S +4 отдает 2 электрона и является восстановителем . Степень окисления марганца уменьшилась от +7 до +2, т.е. Mn +7 принимает 5 электронов и является окислителем .
- Составим электронные уравнения и найдем коэффициенты при окислителе и восстановителе .
S +4 – 2e — = S +6 ¦ 5
Mn +7 +5e — = Mn +2 ¦ 2
Чтобы число электронов, отданных восстановителем, было равно числу электронов, принятых восстановителем, необходимо:
- Число электронов, отданных восстановителем, поставить коэффициентом перед окислителем.
- Число электронов, принятых окислителем, поставить коэффициентом перед восстановителем.
Таким образом, 5 электронов, принимаемых окислителем Mn +7 , ставим коэффициентом перед восстановителем, а 2 электрона, отдаваемых восстановителем S +4 коэффициентом перед окислителем:
5Na 2 S +4 O 3 + 2KMn +7 O 4 + H 2 SO 4 = 5Na 2 S +6 O 4 + 2Mn +2 SO 4 + K 2 SO 4 + H 2 O
- Далее надо уравнять количества атомов элементов, не изменяющих степень окисления, в такой последовательности: число атомов металлов, кислотных остатков, количество молекул среды (кислоты или щелочи). В последнюю очередь подсчитывают количество молекул образовавшейся воды.
Итак, в нашем случае число атомов металлов в правой и левой частях совпадают.
По числу кислотных остатков в правой части уравнения найдем коэффициент для кислоты.
В результате реакции образуется 8 кислотных остатков SO 4 2- , из которых 5 – за счет превращения 5SO 3 2- → 5SO 4 2- , а 3 – за счет молекул серной кислоты 8SO 4 2- — 5SO 4 2- = 3SO 4 2- .
Таким образом, серной кислоты надо взять 3 молекулы:
5Na 2 SO 3 + 2KMnO 4 + 3H 2 SO 4 = 5Na 2 SO 4 + 2MnSO 4 + K 2 SO 4 + H 2 O
- Аналогично, находим коэффициент для воды по числу ионов водорода, во взятом количестве кислоты
6H + + 3O -2 = 3H 2 O
Окончательный вид уравнения следующий:
Признаком того, что коэффициенты расставлены правильно является равное количество атомов каждого из элементов в обеих частях уравнения.
Ионно-электронный метод (метод полуреакций)
Реакции окисления-восстановления, также как и реакции обмена, в растворах электролитов происходят с участием ионов. Именно поэтому ионно-молекулярные уравнения ОВР более наглядно отражают сущность реакций окисления-восстановления. При написании ионно-молекулярных уравнений, сильные электролиты записывают в виде , а слабые электролиты, осадки и газы записывают в виде молекул (в недиссоциированном виде). В ионной схеме указывают частицы, подвергающиеся изменению их степеней окисления , а также характеризующие среду, частицы: H + — кислая среда , OH — — щелочная среда и H 2 O – нейтральная среда.
Рассмотрим пример составления уравнения реакции между сульфитом натрия и перманганатом калия в кислой среде.
- Сначала необходимо составить схему реакции : записать вещества в начале и конце реакции:
Na 2 SO 3 + KMnO 4 + H 2 SO 4 = Na 2 SO 4 + MnSO 4 + K 2 SO 4 + H 2 O
- Запишем уравнение в ионном виде , сократив те ионы, которые не принимают участие в процессе окисления-восстановления:
SO 3 2- + MnO 4 — + 2H + = Mn 2+ + SO 4 2- + H 2 O
- Далее определим окислитель и восстановитель и составим полуреакции процессов восстановления и окисления.
В приведенной реакции окислитель — MnO 4 — принимает 5 электронов восстанавливаясь в кислой среде до Mn 2+ . При этом освобождается кислород, входящий в состав MnO 4 — , который, соединяясь с H + , образует воду:
MnO 4 — + 8H + + 5e — = Mn 2+ + 4H 2 O
Восстановитель SO 3 2- — окисляется до SO 4 2- , отдав 2 электрона. Как видно образовавшийся ион SO 4 2- содержит больше кислорода, чем исходный SO 3 2- . Недостаток кислорода восполняется за счет молекул воды и в результате этого происходит выделение 2H + :
SO 3 2- + H 2 O — 2e — = SO 4 2- + 2H +
- Находим коэффициент для окислителя и восстановителя , учитывая, что окислитель присоединяет столько электронов, сколько отдает восстановитель в процессе окисления-восстановления:
MnO 4 — + 8H + + 5e — = Mn 2+ + 4H 2 O ¦2 окислитель, процесс восстановления
SO 3 2- + H 2 O — 2e — = SO 4 2- + 2H + ¦5 восстановитель, процесс окисления
- Затем необходимо просуммировать обе полуреакции , предварительно умножая на найденные коэффициенты, получаем:
2MnO 4 — + 16H + + 5SO 3 2- + 5H 2 O = 2Mn 2+ + 8H 2 O + 5SO 4 2- + 10H +
Сократив подобные члены, находим ионное уравнение:
2MnO 4 — + 5SO 3 2- + 6H + = 2Mn 2+ + 5SO 4 2- + 3H 2 O
- Запишем молекулярное уравнение, которое имеет следующий вид:
5Na 2 SO 3 + 2KMnO 4 + 3H 2 SO 4 = 5Na 2 SO 4 + 2MnSO 4 + K 2 SO 4 + 3H 2 O
Na 2 SO 3 + KMnO 4 + H 2 O = Na 2 SO 4 + MnO 2 + KOH
В ионном виде уравнение принимает вид:
SO 3 2- + MnO 4 — + H 2 O = MnO 2 + SO 4 2- + OH —
Также, как и предыдущем примере, окислителем является MnO 4 — , а восстановителем SO 3 2- .
В нейтральной и слабощелочной среде MnO 4 — принимает 3 электрона и восстанавливается до MnО 2 . SO 3 2- — окисляется до SO 4 2- , отдав 2 электрона.
Полуреакции имеют следующий вид:
MnO 4 — + 2H 2 O + 3e — = MnО 2 + 4OH — ¦2 окислитель, процесс восстановления
SO 3 2- + 2OH — — 2e — = SO 4 2- + H 2 O ¦3 восстановитель, процесс окисления
Запишем ионное и молекулярное уравнения, учитывая коэффициенты при окислителе и восстановителе:
3SO 3 2- + 2MnO 4 — + H 2 O =2 MnO 2 + 3SO 4 2- + 2OH —
3Na 2 SO 3 + 2KMnO 4 + H 2 O = 2MnO 2 + 3Na 2 SO 4 + 2KOH
И еще один пример — составление уравнения реакции между сульфитом натрия и перманганатом калия в щелочной среде.
Na 2 SO 3 + KMnO 4 + KOH = Na 2 SO 4 + K 2 MnO 4 + H 2 O
В ионном виде уравнение принимает вид:
SO 3 2- + MnO 4 — + OH — = MnO 2 + SO 4 2- + H 2 O
В щелочной среде окислитель MnO 4 — принимает 1 электрон и восстанавливается до MnО 4 2- . Восстановитель SO 3 2- — окисляется до SO 4 2- , отдав 2 электрона.
Полуреакции имеют следующий вид:
MnO 4 — + e — = MnО 2 ¦2 окислитель, процесс восстановления
SO 3 2- + 2OH — — 2e — = SO 4 2- + H 2 O ¦1 восстановитель, процесс окисления
Запишем ионное и молекулярное уравнения , учитывая коэффициенты при окислителе и восстановителе:
SO 3 2- + 2MnO 4 — + 2OH — = 2MnО 4 2- + SO 4 2- + H 2 O
Na 2 SO 3 + 2KMnO 4 + H 2 O = 2K 2 MnO 4 + 3Na 2 SO 4 + 2KOH
Необходимо отметить, что не всегда при наличии окислителя и восстановителя, возможно самопроизвольное протекание ОВР. Поэтому для количественной характеристики силы окислителя и восстановителя и для определения направления реакции пользуются значениями окислительно-восстановительных потенциалов.
Категории ,Дано задание: «По данным схемам составьте схемы электронного баланса». Как его выполнить? Что для этого потребуется? Попробуем разобраться вместе.
Суть метода
Для начала остановимся на том, что представляет собой данный метод. Если схема электронного баланса составлена правильно, можно поставить в предложенной реакции все стереохимические коэффициенты.
Суть данной методики заключается в определении степеней окисления отдельных элементов, которые участвовали во реакции. Если в левой и правой частях уравнения у элемента сохраняется постоянная то схема электронного баланса составляется без него.
У элементов, которые поменяли свою степень окисления в процессе взаимодействия, полученные значения учитываются при вычислениях наименьшего общего кратного.

Как составить баланс
Для начала вам придется поставить у каждого элемента его степени окисления, пользуясь определенными правилами. Если во взаимодействие вступало простое вещество, то оно не принимает, а также не отдает другому элементу электроны, следовательно, его степень окисления равна нулю. Примерами соединений с нулевой степенью окисления являются молекулы галогенов, металлы.
В бинарном соединении у второго элемента степень окисления имеет отрицательное, а у первого - положительное значение. В сумме (с учетом числа атомов) должен получиться ноль. В оксиде кальция, например, у первого элемента степень окисления +2, а у второго (кислорода) -2. Суммарное их значение равно нулю, так как молекула нейтральна.
Если необходимо расставить степени окисления в более сложном веществе, то сначала определяют показатели у первого и последнего элементов. Затем, пользуясь математическими вычислениями, определяют степень окисления у центрального элемента. Сумма всех показателей должна быть равна нулю.

Алгоритм действий
Как же составляется схема электронного баланса? В левой ее части записывают вместе со степенями окисления элементы, которые участвовали в окислительно-восстановительном процессе.
Далее знаками «плюс» и «минус» указывается количество принятых и отданных электронов в ходе химического взаимодействия. Между определяется наименьшее общее кратное. Напомним, что под ним подразумевается положительное число, которое будет без остатка делиться на обе цифры, касающиеся электронов.
Схема электронного баланса считается полной в том случае, когда в ней определены и коэффициенты. Как их найти? необходимо разделить на принятые и отданные в процессе электроны. Полученные цифры и будут стереохимическими коэффициентами.
Важно также определить восстановитель и окислитель, а также протекающие при взаимодействии процессы (окисление и восстановление). Полученная схема электронного баланса окислительно-восстановительного процесса позволит вам расставить недостающие коэффициенты в реакции.

Задания на ОВР в итоговой аттестации
На основании данного метода выпускникам предлагается выполнение задания из уровня «С». Успешность зависит от уровня практических навыков ученика, степени владения теоретическими основами.
Например, в задании сказано: по данным схемам составьте схемы электронного баланса. Кроме того, часть реагирующих веществ, а также некоторые продукты взаимодействия могут быть упущены. Данный вопрос считается заданием повышенной сложности, поэтому предполагает определенную последовательность рассуждений.
Для начала у всех элементов в известных веществах определяют степени окисления, затем записывают вещества, которых не хватает в обеих частях реакции.
В тестах ЕГЭ по химии предполагается отдельная запись веществ, непосредственно участвующих в уравнении, с последующим указанием окислителя и восстановителя.
Заключение
Такой метод является далеко не единственным способом расстановки коэффициентов в уравнении. Можно воспользоваться и который позволяет уравнивать сразу все вещества, записанные в уравнении.